Chacun de nous a des croyances - obtenues par l'observation, l'expérience ou même l'éducation formelle - qui se sont révélées tard fausses. En fait, la formation médicale commence par un avertissement:
«La moitié de tout ce qui vous sera enseigné sera prouvée faux à l’avenir, mais
dont la moitié ne peut pas être connue pour le moment! Quelques croyances récemment «renversées»
impliquer le microbiome intestinal humain, à commencer par sa portée, sa diversité et,
actuellement, les différentes façons dont il affecte et est affecté par le corps. Voici une
examen de ce que l'on sait maintenant et de ce qui fait actuellement l'objet d'une enquête.
Vue d'ensemble: le microbiome humain
Le microbiome humain, dans son ensemble, est le
population de toutes les formes de vie microscopiques qui vivent et se développent chez l'humain
organisme. Chaque zone de notre corps, comme la peau, les oreilles, les poumons ou l'intestin, a des
populations microbiennes et diversité. Même dans un organe, le microbiome peut
être unique à des emplacements anatomiques spécifiques.
Aujourd'hui, le microbiome humain est considéré comme un sys organique,
révolutionnant notre compréhension de la santé humaine, de la maladie et de la condition physique (Baquero
2012). Le microbiome humain peut être facilement et rapidement altéré par un événement ou
des événements comme l'introduction d'antibiotiques. Ceci est bien sûr également vrai pour
les sous-ensembles de ce sys, y compris le microbiome dans l'intestin humain.
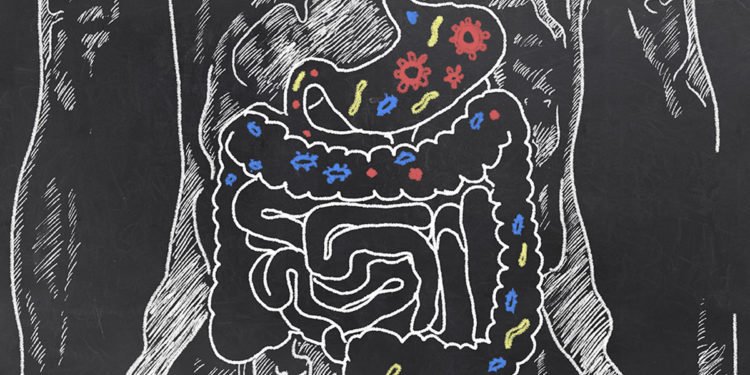
Se concentrer sur: les micro-organismes intestinaux
Les dimensions du microbiome intestinal sont
décrit en termes astronomiques. Les 100 billions de microbes de l'intestin
le microbiome dépasse largement la population de cellules humaines de 37 billions de dollars. Par gène
compte, le multiple est grand, avec 20 000 gènes humains et ieurs millions
microbial genes (Sender, Fuchs & Milo 2016).
Le microbiome intestinal humain contient ieurs types de
microorganismes, y compris les bactéries, virus, protistes, champignons, parasites et
prions (Alberts et al.2002). Un nombre limité sont connus pour être des agents pathogènes, ou
micro-organismes qui peuvent causer des maladies. Souvent, une souche ou une sous-espèce sélectionnée
donner lieu à une maladie spécifique; par exemple, le microbe Salmonella typhi
provoque la fièvre typhoïde. Si l'on sait qu'un type de microorganisme ne cause aucun dommage, il
est étiqueté commensal et, s'il est bénéfique, il est appelé symbiote.
Pour
de nombreuses années, on croyait qu'il n'y avait que ieurs dizaines d'espèces de microbes
dans l'intestin, en grande partie à cause de la manière dont les micro-organismes ont été identifiés.
Traditionnellement, les méthodes impliquaient l'ajout d'une tache spéciale à un échantillon ou l'observation
la croissance de colonies sur un milieu tel que la gélose au sang.
Quand
le séquençage des gènes a été introduit, il a permis l'identification des microbes par leur
ADN et ARN. Les scientifiques se sont vite rendu compte que les espèces comptaient les microbes intestinaux
était en fait dans le des millions. (Ainsi, jusqu'à ce que toutes les espèces de microbiote intestinal
sont identifiés et étudiés, nos tentatives de manipulation de l'intestin
microbiome avec des probiotiques et d'autres mesures peuvent conduire à
conséquences.)
ADN
le séquençage a également conduit à une autre découverte sur la diversité des microbes dans le
intestin humain. Pendant des décennies, le sys de classification de la vie sur Terre a inclus
ieurs domaines, subdivisés en royaume, phylum, classe, famille, ordre,
genre et espèce. Puis, à la fin des années 1970, Carl Woese, PhD, à l'Université de
Illinois, Urbana-Champaign, a découvert l'ancien domaine archées (Sapp
& Fox 2013). For many years, archaea were believed to be bacteria, but when
leur ADN a été séquencé, ils se sont avérés être extraterrestres que toute forme de vie
encore découvert.
Archée
sont extrémophiles—Microorganismes capables de survivre dans des environnements extrêmes
(Rampelotto 2013). Ils ont été trouvés vivant dans des roches, volcanique du fond de l'océan
évents, sources minérales bouillantes et même espace extra-atmosphérique. En fait, la nouvelle science
de l'astrobiologie les considère comme un candidat de choix pour la première vie sur Terre,
peut-être arrivé d'un autre sys solaire. Fait intéressant, ils sont également
trouvé dans le microbiome intestinal humain.

Récemment,
des découvertes surprenantes ont également été faites concernant le transfert de gènes. le
croyance que les gènes ne pourraient passer à la génération suivante que par
la transmission (du parent à la progéniture) a été annulée par la lauréate du prix Nobel Barbara McClintock, PhD, qui a découvert les «gènes sauteurs»
(Ravindran 2012). Ces gènes permettent le transfert horizontal de la génétique
information, c'est-à-dire entre deux espèces différentes!
COMMENT LES GÈNES AFFECTENT LE GUT
Les gènes du microbiome sont essentiels pour l'homme
survie. Les gènes du microbiome - ainsi que de son alimentation et
environnement - peut être actif, être transféré horizontalement ou agir comme épigénétique
influenceurs (Carbonero 2017).
Nous sommes
exposés à des millions de gènes et de facteurs épigénétiques provenant de notre alimentation, de l'eau et
environnement. Prébiotiques, probiotiques, synbiotiques, alimentation, antibiotiques,
Produits pharmaceutiques, toxines, lumière du soleil, exercice, sexe, pollution de l'air, sommeil,
le tabagisme, le stress et d'autres facteurs peuvent influencer l'expression des gènes et
affect health and well-being (Conlon & Bird 2015; Kashtanova et al. 2016;
Imhann et al. 2017; Allen et al. 2018; Clark & Mach 2017; Jašarević,
Morrison & Bale 2016; Beamish, Osornio-Vargas & Wine 2011; Benedict et
al. 2016; Reynolds et al. 2017; Lutgendorff, Akkermans & Söderholm 2008).
le
la biodiversité des sources alimentaires expose l'intestin à des millions de gènes uniques provenant
des dizaines de milliers d'espèces et de cultivars. Bien qu'il y ait des inquiétudes concernant
ingérant des organismes génétiquement modifiés (OGM), ils ont été
de 10000 ans sous diverses formes, des céréales croisées aux
bétail (Oliver 2014). De , une recherche collaborative internationale
le programme appelé Human Genome Project a découvert que 8% du génome humain
n'est pas d'origine humaine et a été transféré horizontalement à partir de virus anciens,
faisant ainsi humains correspondent à la désignation des OGM. Des recherches supplémentaires suggèrent
qu'un pourcentage encore élevé du génome humain peut provenir d'autres
species (Horie et al. 2010).
L'impact de l'intestin sur le corps
Il existe ieurs voies de communication
entre le cerveau et l'intestin, le important
étant le nerf vague (Breit et al.2018). Sur la communication bidirectionnelle active, de 90% se fait de l'intestin vers
the brain (Bonaz, Bazin & Pellissier 2018). The gut microbiome houses some
70% du sys immunitaire (Vighi et al.2008) et communique avec le sys immunitaire
sys, sys lymphatique, sys endocrinien (hormones) et sys circulatoire. Métabolites, neurotransmetteurs, hormones,
les cytokines, les signaux électriques et les marqueurs inflammatoires sont générés par l'intestin
microbiome lui-même - ou des cellules gastro-intestinales influencées par celui-ci.
dans le
des mois et des années à venir, la science factuelle identifiera des souches spécifiques
des microbes comme agents pathogènes ou symbiotes, permettant une modification thérapeutique du
microbiome. Voici quelques éléments actuellement connus et sous enquête.
Conditions de santé. Changes in the gut microbiome are associated with a variety of health conditions, including autism, arthritis, cancer, heart disease, depression and others. Therapeutic microbes are likely to be identified for obesity (Rouxinol-Dias et al. 2016), heart disease, diabetes (Zeevi et al. 2015; Sanz et al. 2018) and other common conditions, opening new approaches to prevention and management (Kuntz & Gilbert 2017; Thursby & Juge 2017).

Syndrome de l'intestin qui fuit. Le microbiome intestinal affecte les jonctions serrées qui maintiennent l'intégrité de la barrière intestinale. Lorsque les jonctions serrées sont affaiblies, les espaces entre les cellules de la muqueuse intestinale peuvent conduire au «syndrome de l'intestin qui fuit», qui permet aux microbes, métabolites et toxines de passer du sys digestif à la circulation sanguine.
Santé mentale. Les microbes qui fabriquent des métabolites, des hormones et des neurotransmetteurs spécifiques - tels que la sérotonine, la dopamine, l'acétylcholine ou leurs précurseurs - peuvent être utilisés pour les troubles de l'humeur et sont déjà décrits comme des psychobiotiques (Sarkar et al.2016; Bastiaanssen et al.2018; Lach et al. 2018).
Obésité. Le microbiome intestinal facilite la digestion des aliments. L'absorption des calories et des nutriments, l'indice glycémique et la régulation énergétique dépendent de que de la nourriture consommée. Ces fonctions dépendent également de la diversité de la population microbienne intestinale, avec des espèces et des souches de microbes spécifiques extrayant de calories des aliments que d'autres, contribuant potentiellement à l'obésité ainsi qu'au diabète de type 2 et au syndrome métabolique.
Métabolisme. Certains microbes intestinaux peuvent produire des hormones similaires aux hormones humaines qui régulent le métabolisme (comme l'activité de type DPP4). D'autres peuvent moduler la fonction immunitaire et métabolique - par exemple, les microbes peuvent augmenter les niveaux d'adiponectine dans le tissu adipeux, augmenter l'activation de l'AMPK dans le tissu squelettique et adipeux et modifier les niveaux de ghréline (Yanagi et al.2017; Olivares et al.2018).
Santé globale. L'exercice peut également exprimer certains de ses avantages à travers le microbiome intestinal. Et notre ry circadien, qui régule le sommeil, à la fois influence et est influencé par le microbiome intestinal.
L'objectif final: la diversité du microbiote intestinal
Les preuves scientifiques appuient la conviction que
la diversité du microbiome intestinal est grande, l'individu est en santé
(Lozupone et al.2012). Bien que ce ne soit pas une connaissance avérée, travailler
éliminer les antibiotiques (ainsi que les édulcorants et herbicides artificiels, qui
ont des propriétés antibiotiques) de l'approvisionnement alimentaire semble logique, car
les antibiotiques tuent les bonnes bactéries intestinales ainsi que les bactéries nocives (Prashant et al.
2012). Il semblerait également prudent d'encourager la diversité du microbiome à travers
la consommation d'une variété d'aliments fermentés et respectueux de l'intestin, tels que le kimchi,
yaourt et choucroute.
Malheureusement,
l'industrie des probiotiques a un but lucratif - d'environ 50 milliards de dollars par an
(Turner 2016) - pour renverser cette logique, en incitant le consommateur à
avaler un produit commercial contenant des milliards d'un seul (ou quelques-uns)
espèces microbiennes - tous les jours, indéfiniment. Cependant, cela tend à soutenir
l'uniformité microbienne de l'intestin, qui est l'opposé de la
la diversité. Cela dit, les chances de l'espèce microbienne dans un yogourt étant
exacnt ceux dont le microbiome intestinal a besoin pour une santé optimale serait comme
gagner la loterie probiotique.
Simplement
En d'autres termes, notre santé et notre bien-être peuvent dépendre de la diversité de notre microbiome.
Ainsi, en ce qui concerne les probiotiques, nous serions bien servis de suivre la sagesse
de la grande illumination écossaise du XVIIIe siècle
philosophe David Hume: «Un homme sage proportionnera sa croyance à l'évidence.»
C’est un petit monde après tout, surtout dans le microbiome!
Apprenez des faits intéressants sur des sujets d'actualité en nutrition Certification nutritionnelle Clenbuterolfr. Découvrez comment devenir coach en nutrition certifié en aussi peu que 12 semaines.

Joseph Weiss, MD, FACP, FACG, est professeur clinique de gastro-entérologie à l'Université de Californie à San Diego. Il est un conférencier professionnel reconnu, auteur (smartaskbooks.com), consultant et défenseur.

Danielle Weiss, MD, FACP, est professeur adjoint de clinique d'endocrinologie et de métabolisme à l'Université de Californie à San Diego. Elle est également directrice médicale et fondatrice du Center for Hormonal Health and Well-Being à Encinitas, Californie (centerforhormonalhealth.com).





.jpg?width=330&name=Optima%20Ads_blog3%20(1).jpg)